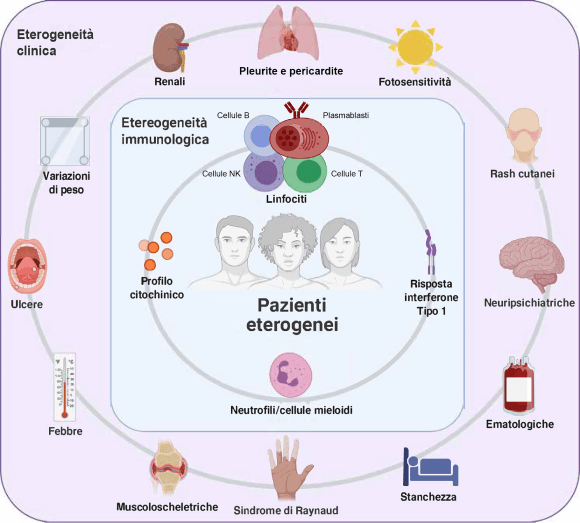
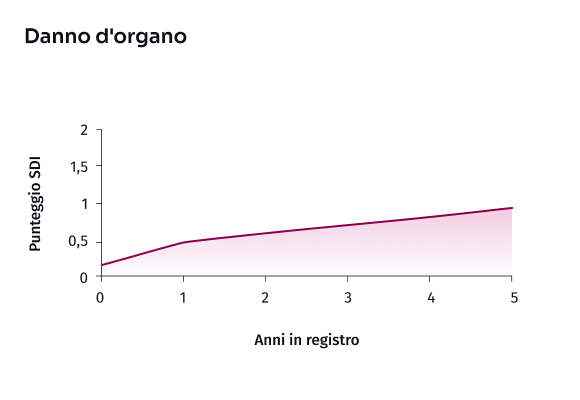
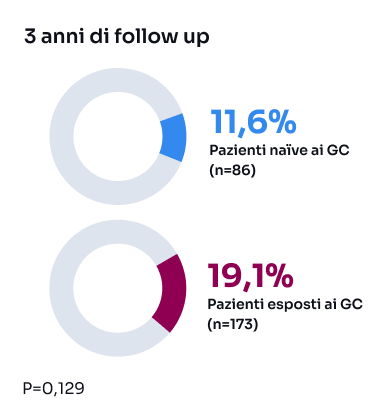
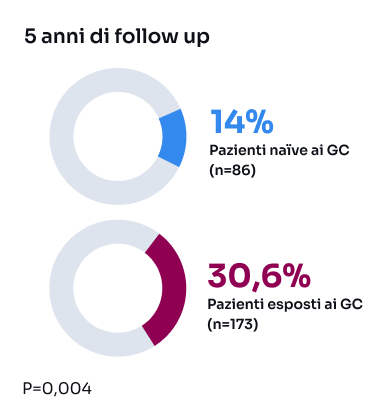
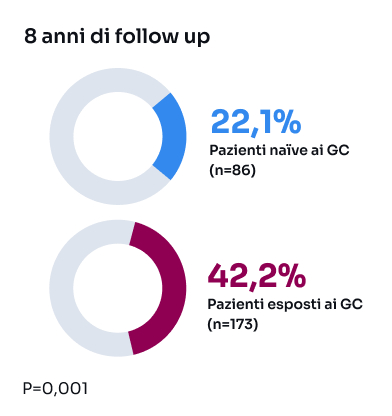
GC: glucocorticoidi; LES: Lupus eritematoso sistemico; SDI: Systemic Lupus International Collaborating Clinics/American College of RheumatologyDamage Index; SLEDAI-2K: Systemic Lupus Erythematosus Disease Activity Index 2000; SLICC: Systemic Lupus International Collaborating Clinics.